Esercizi svolti di termodinamica
Proprio l’altro giorno, durante una lezione di fisica mi sono trovata di fronte alla termodinamica, per svolgere alcuni esercizi, in vista di un esame. Mentre eravamo assorti nello svolgimento dei problema, ho pensato “quanto è bella la termodinamica”! 🙂 Ha un fascino quasi filosofico!!
Per questo, per fissare quel pensiero, ho deciso di scrivere e svolgere i problemi in questione 😉
Una mole di gas ideale monoatomico si espande assorbendo 3000J di calore. Sapendo che il lavoro (W) compiuto dal gas è pari al doppio della sua variazione di energia interna, si calcoli la variazione di temperatura del gas.
Prima di tutto, scriviamo i dati del problema:
QA=3000J
W=2ΔU
Ora, ricordiamo che la variazione di energia interna è legata alla variazione di temperatura, essendo
ΔU=ncvΔT=3/2RΔT, (*)
dove abbiamo tenuto in considerazione che n=1 (numero di moli) e che il gas è monoatomico, quindi il calore specifico molare a volume costante è cv=3/2R (R=8,31J/(K mole).
Per il Primo Principio della Termodinamica sappiamo che
Q-W=ΔU
e che W=2ΔU, quindi ΔU=Q/3=1000J.
A questo punto, abbiamo “legato” le variabili e possiamo rispondere al quesito del problema, calcolando la variazione di temperatura, perché la ricaviamo dalla (*):
ΔT= 2ΔU/(3R)=80,2K
L’altro problema è il seguente:
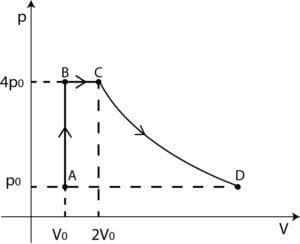
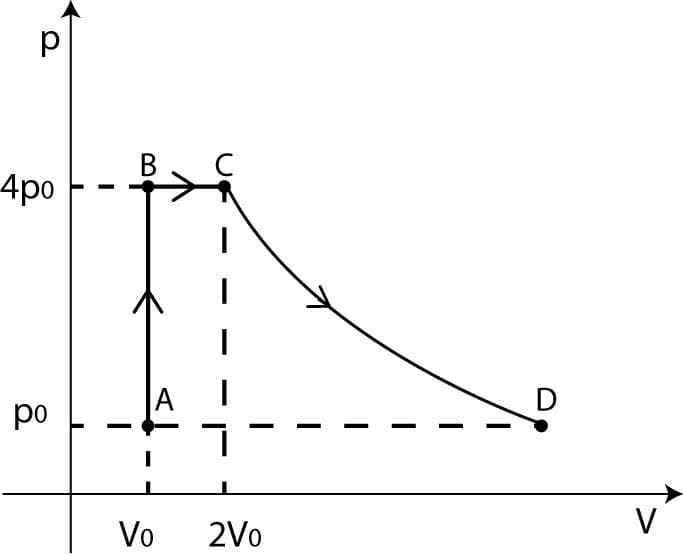
Una mole di gas ideale monoatomico si trova inizialmente in uno stato A con volume V0 e pressione p0 a temperatura T=300K ed è sottoposto alla seguente equenza di trasformazioni:
A→B: compressione isocora (volume costante) fino alla pressione 4p0;
B→C: espansione isobara fino al volume 2V0;
C→D: espansione isoterma fino alla pressione p0.
Si calcolino il lavoro compiuto ed il calore scambiato dal gas durante la sequenza di trasformazioni.
E’ conveniente calcolare volume, pressione e tempaeratura negli stati A, B, C e D.
A: volume, pressione e temperature sono quelli iniziali, Vo, po, To e l’equazione di stato è
poVo=nRTo
B: poichè la compressione avviene a volume costante, VB=Vo, pB=4po, e la temperatura è una generica TB; la corrispondente equazione di stato è
4poVo=nRTB
Dal confronto delle equazioni di stato rispetto ad A e B si ottiene (basta dividere membro a membro) TB=4To.
C: VC=2Vo, pC=pB=4po (espansione a pressione costante) e l’equazione di stato è
4po2Vo=nRTC
che, confrontata con l’equazione allo stato A (ancora dividendo membro a membro) si ha TC=8To.
D: volume VD, pressione pD=po, temperatura TD=TC=8To, (espansione a temperatura costante), la cui uqeuazione di stato è
VDpo=8nRTo
Per calcolare il lavoro, ricordiamo che la grandezza è additiva, per cui basta calcolare i lavori durante le 3 trasformazioni:
WAB=0, perchè isocora
WBC=
Nella trasformazione C→D occorre ricordare che l’espansione avviene e a temperatura costante e che quindi può essere portata fuori dall’integrale , dopo aver ricavato T dall’equazione di stato (ddobbiamo scriverla in funzione di V):
WCD=
Ora, basta solo sostituire i valori numerivi per avere il lavoro complessivo: W=37600J.
Per calcolare il calore scambiato, ricorriamo al primo principio della termodinamica: Q=ΔU+W (
Ricordiamo che la variazione di energia interna per un gas monoatomico è data da ΔU=ncvΔT=ncv(TD-TC)=26200J
Pertanto, (
A chi potrebbe piacere questo articolo?

Maria Grazia Pastore
E’ consulente all'apprendimento e Docente di Matematica Creativa.
E’ ideatrice del “Metodo MG” per l’apprendimento pratico e facilitato delle materie scolastiche e universitarie.
E’ laureata in matematica indirizzo applicativo, orientamento logico-informatico. Ha svolto la tesi e studi sulla costruzione di curve e superfici nella grafica computerizzata con Open GL.
E’ autrice di diversi ebook e video corsi di matematica e di tecniche di apprendimento per studenti e insegnanti. Scrive per diverse riviste scientifiche e siti. Tra i suoi diversi incarichi ha offerto la sua consulenza ad aziende e professionisti.

Sei stanco di studiare troppo e senza profitto?


Migliora le tue capacità di apprendimento!
L’ebook (.pdf) è completamente GRATUITO e si legge velocemente, quindi potrai iniziare subito ad applicare i preziosi consigli. Inserisci la tua email così da ricevere la guida nella tua casella di posta elettronica, inoltre riceverai anche altri nuovi consigli nei prossimi giorni.

NO SPAM! Potrai cancellarti con un click.